Contoh Soal Konfigurasi Elektron akan membahas pengetahuan seputar mata pelajaran kimia yang berkaitan dengan atom. Dimana pada umumnya, konfigurasi elektron akan dikenalkan ataupun diajarkan pada siswa SMA kelas 10 atau sederajat.
Berbicara seputar atom dari sudut pandang kimia, maka akan membahas mengenai tiga hal utama, yaitu inti atom (neutron), proton, dan elektron. Elektron sendiri merupakan bagian yang bergerak bebas disekitar sehingga sebuah unsur bisa saling terikat satu dengan lainnya.
Meskipun dapat dikatakan bebas bergerak, elektron juga mempunyai konfigurasi khusus. Dimana konfigurasi elektron dipengaruhi oleh jumlah elektron serta kulit atom. Kulit itu merupakan gambaran posisi elektron dalam mengintari neutron. Kulit atom dinamai dengan huruf mulai dari K, L, M, N, dan seterusnya.
Konfigurasi elektron juga memiliki kaidahnya sendiri atau dengan kata lain penempatan elektron pada kulit tertentu tidak bisa sembarangan. Konfigurasi elektron ada prinsip, aturan serta larangan khususnya. Pada artikel Kursiguru ini akan dijelaskan seputar materi hingga contoh soal konfigurasi elektron di mapel kimia.
Contoh Soal Konfigurasi Elektron
Sebelum kamu mulai mengerjakan contoh soalnya, bacalah informasi materi dasar mengenai konfigurasi elektron berikut ini.
Seputar Konfigurasi Elektron
Konfigurasi elektron merupakan gambaran pemposisian semua elektron dari sebuah unsur kimia pada kulit atomnya. Nah, di materi ini kamu akan menemukan istilah sub-kulit dan tingkat energi. Keduanya merupakan dasar penentuan konfigurasi elektron.
Untuk sub-kulit terbagi menjadi 4 jenis, yaitu sub-kult s, p, d, f. Masing-masing sub-kulit tersebut memiliki batas maksimal pengisian elektron dengan ketentuan:
- s = 2
- p = 6
- d= 10
- f = 14
Pembagian sub-kulit di atas juga dipengaruhi oleh jumlah elektron maksimum dalam sebuah kulit. Pembagian itu memiliki ketentuan sebagai berikut.
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 6f 8s
Sebagai contoh, unsur Cu memiliki 29 elektron maka konfigurasi elektron Cu adalah:
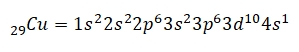
Dari contoh soal di atas, bisa diketahui bahwa semakin banyak jumlah elektron maka pengkonfigurasiannya akan semakin panjang juga. Untuk mengatasi masalah itu ketika mengerjakan contoh soal, pakailah sistem penyingkatan.
Contoh Penyingkatan Konfigurasi Elektron
Setelah kamu tahu bagaimana cara dasar mengerjakan soal konfigurasi elektron seperti di atas, sekarang lanjut ke materi penyingkatan konfigurasi elektron. Penyingkatan di sini menggunakan unsur golongan VII A sebagai dasarnya, yaitu:
– Helium [He] : 2
– Neon [Ne] : 10
– Argon [Ar] : 18
– Kripton [Kr] : 36
– Xenon [Xe] : 54
-Radon [Rn] : 86
Dimana masing-masing unsur di atas memiliki konfigurasi elektron sebagai berikut.

Sebagai contoh gunakan lagi unsur tembaga atau Cuprum agar bisa membandingkan penulisan biasa dengan yang disingkat.
Karena jumlah elektron tembaga adalah 29 maka nilai terdekat dibawahnya adalah Argon (18), jadi kamu hanya perlu menuliskan 11 elektron di luar konfigurasi milik Argon. Sehingga contoh konfigurasi singkat tembaga adalah:
![]()
Kaidah Menggambar Diagram Orbital
Pada materi konfigurasi elektron ada 3 (tiga) jenis kaidah dalam menggambar Diagram Orbital, yaitu:
1.Prinsip Aufbau (Aufbau Principle)
Ketika mengerjakan soal diagram orbital, proses pengisian elektron harus diawali dari tingkat energi rendah ke tinggi.
2. Aturan Hund (Hund’s Rules)
Ketika mengerjakan contoh soal, pengisian elektron pada sub-kulit dengan orbital lebih dari satu, maka elektron akan disebar ke semua orbital yang energinya sama serta arah spin nya juga sama.
3. Larangan Pauli (Pauli’s Prohibition)
Pada sebuah atau satu orbital hanya bisa diisi 2 (dua) buah elektron. Kedua elektron itu harus mempunyai arah spin yang berbeda.
Download Contoh Soal Konfigurasi Elektron
Nah agar kamu semua lebih bisa memahami konfigurasi elektron, alangkah baiknya untuk langsung mengerjakan contoh soal. Contoh soal konfigurasi elektron bisa didownload langsung serta gratis melalui link dari kursiguru berikut ini.
Download Contoh Soal Konfigurasi Elektron
Tujuan utama kursiguru memberikan contoh soal mapel kimia di atas tidak lain adalah menyediakan sarana bagi siswa dan guru lain. Jadi silakan gunakan soal konfigurasi elektron dengan sebaik-baiknya.

